
< Cryo Electrom Microscopy (Cryo-EM) 으로 규명한 DOT1L – 유비퀴틴 뉴클레오좀 복합체 구조 >
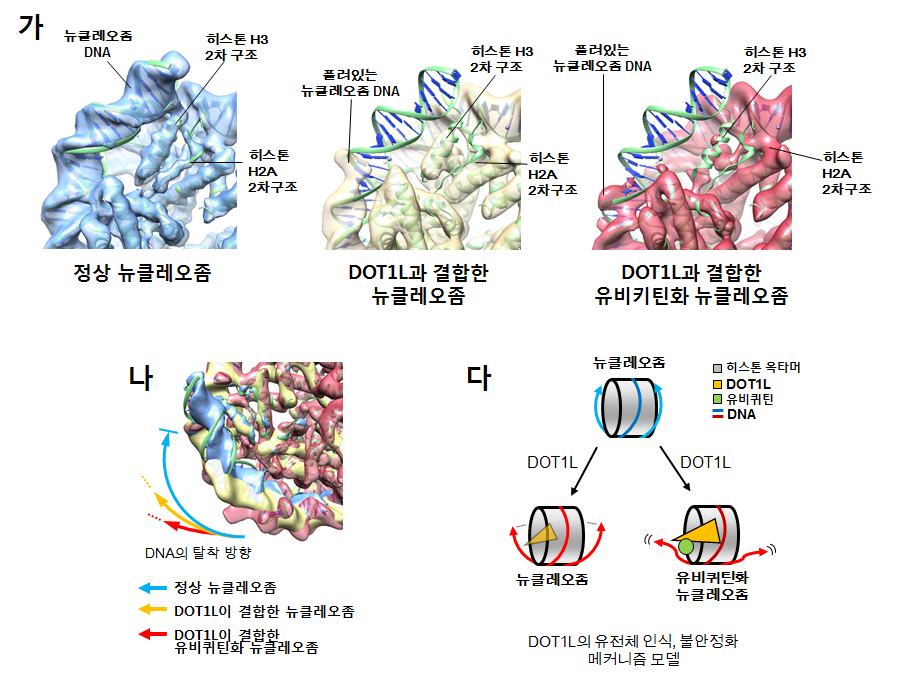
< 정상적인 뉴클레오좀 (파란색, 녹색)과 비교했을 때, DNA가 풀려 사라지고 히스톤 2차 구조가 손실되는 불안정화 현상이 관찰됨 (빨강) >
1. 배경지식 Histone tail의 methylation, acetylation, ubiquitination, phosphorylation 등을
비롯한 화학적 변형이 유전자의 발현과 세포 대사에 영향을 준다는 것은 널리 알려진 사실이지만, 상대적으로
효소의 접근이 어려운 histone의 body site에서
일어나는 변형은 그 메커니즘에 대해 이해된 바가 적습니다. Histone H3의 79 Lysine에서 일어나는 methylation 역시 그 예 중
하나로, gene transcription activation, DNA damage response, cell
cycle regulation 등의 다양한 생명 활동에 직접적으로 연관되어 있지만, 유동성이
적은 nucleosome body 중앙부의 lysine에
어떻게 methylase가 접근해 methylation을
일으키는지는 알려지지 않았습니다.
DOT1L은 현재 H3 79
Lysine을 methylation시킨다고 알려진 거의 유일한 enzyme이며, DOT1L의 과 활성화에 의한 H3 K79 over-methylation이 백혈병의 발병, 발달에
치명적이라고 알려지며 의학적으로도 관심을 받고 있는 단백질입니다. 또한 histone H2B의 C-terminal 120 Lysine
ubiquitination이 DOT1L의 활성화에 중요하단 것이 알려지며 다른 epigenetic histone code와의 연관성이 주목 받고 있었습니다.
2. 질문 저희는 본 연구를 통해 DOT1L과 일반적인 nucleosome, 그리고 H2B가 ubiquitination된 변형 nucleosome의 복합체를 구성하고
그 구조를 초저온 전자현미경 (cryo-EM) 기술을 통해 규명했습니다. 규명된 구조를 분석하여 (1) DOT1L이 어떻게 nucleosome의 body site에 안정적으로 결합하는지 규명하고
(2) H2B의 C-terminal ubiquitination이
어떻게 DOT1L의 기능을 강화시키는지 확인하고자 했습니다.
3. 발견 DOT1L의
catalytic site는 C-terminal의
hydrophobic patch를 ubiquitin에,
double arginine loop를 nucleosome의 acidic patch에 마치 닻을 내리듯 결합하고 있었습니다. 그리고 N-terminal 방향으로는 nucleosome의 body를 횡으로 넓게 덮으며 catalytic channel을 목표
아미노산인 H3 79 Lysine에 접근시키고 있습니다. 이것은
마치 경첩 (hinge) 구조 같은 것인데, 일반 nucleosome과 ubiquitinated nucleosome의
구조를 비교했을 때 ubiquitin의 결합이 DOT1L을
회전시켜 catalytic site에 더 가깝게 위치시키는 것을 확인했습니다. 흥미로웠던 것은, 구조를 분석하면서 DOT1L이 기존에 알려진 methylase 기능뿐만 아니라 nucleosome 불안정화 기능을 가진 것을 확인한 점이었습니다.
DOT1L이 결합한 nucleosome은 histone octamer를 감싸고 있는 DNA가 풀리며 그와 결합한 histone secondary structures들이 손실되는 등의 불안정화된 모습을 보였습니다. 실제 DNA detachment가 발생한다는 사실을 서울대학교 홍성철
교수님 연구실과의 single molecule FRET 실험을 통해 검증함으로써, DOT1L이 methylase로서의 catalytic activity 외에 nucleosome
destabilization, 유전체 불안정화 기능을 가진다고 최초로 보고하였습니다. 이
기능은 DOT1L의 methylase activity와 깊게
연관된 H2B ubiquitination, H2A acidic patch interaction이 있을
때 강화된다는 것이 관찰되어, 마찬가지로 다른 histone과 cross-talk을 형성하고 있음을 확인하였습니다.
5. 후속 DOT1L 연구를 해오면서 ubiquitinated nucleosome을 직접 만들 수 있는 기술을 습득했는데, 어렵게 얻은 기술인 만큼 이 유전체를 활용한 다양한 연구를 계획해보고자 합니다. 또 DOT1L의 story를
확장시키는 방법에 대해서도 계속해서 고민해오고 있습니다.
6. 소감 논문이 마무리되기까지 물심양면으로 지원해주신 송지준
교수님께 감사드립니다. 그리고 함께 연구를 수행해 온 공동 연구자 분들과, 많은 조언과 도움을 준 연구실 멤버들에게도 감사의 말씀을 드립니다.







 신왕용 (시냅스뇌질환 연구실, 김은준 교수님)
신왕용 (시냅스뇌질환 연구실, 김은준 교수님)
 정창욱, 하승민 (시냅스뇌질환 연구실, 김은준 교수님)
정창욱, 하승민 (시냅스뇌질환 연구실, 김은준 교수님)



















