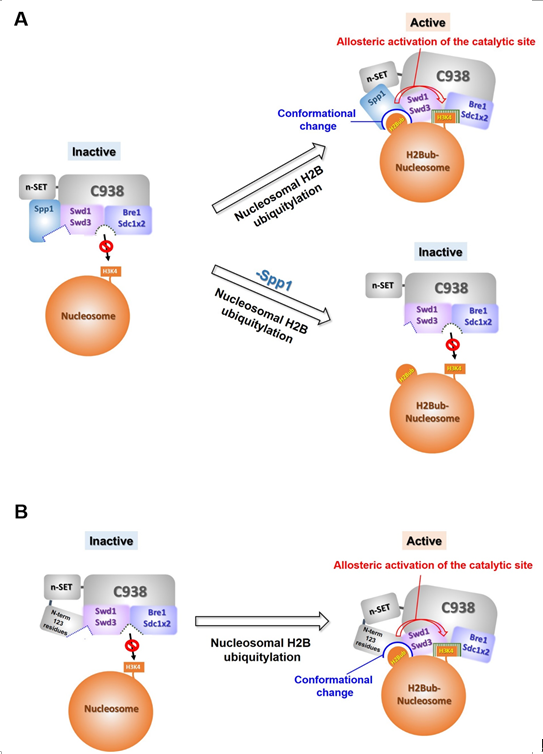
<효모 Set1 complex 의 H2B ubiquitylation 의존적 H3K4 methylation 기작>
1. 배경지식
핵산인 DNA와 단백질인 히스톤은 염색체의 기본 구성인자인 nucleosome을 이룹니다. DNA를 기반으로 하는 다양한 생명현상들 예컨데 DNA replication, DNA repair, DNA recombination, RNA transcription 등은 많은 경우에 해당 기능을 담당하는 분자들이 DNA에 얼마나 접근할 수 있는지에 따라 조절됩니다. 이러한 DNA에 대한 접근성 (DNA accessibility)를 조절하는 중요한 요소 중 하나는 바로 DNA와 붙어 있는 히스톤에 일어나는 여러 종류의 modification 입니다. 대표적으로 methylation, acetylation, phosphorylation, ubiquitylation 등이 있으며 어떤 종류의 modification은 DNA accessibility를 증가시키거나 감소시키며 상황에 따라서는 한 종류의 modification이 서로 다른 여러 가지 역할을 할 수도 있습니다. 제가 연구하고 있는 히스톤 H3K4 methylation 은 히스톤 H3 단백질의 네 번째 lysine 잔기(K4)에 일어나는 methylation 으로 활발하게 transcription이 일어나고 있는 염색사 상에 많이 위치하며 transcription이 잘 일어나는데 중요하다고 알려져 있습니다. 때문에 H3K4 methylation이 잘못 조절될 경우 암을 포함한 여러 질병들이 발생합니다. H3K4 methylation은 가장 단순한 진핵세포인 효모로부터 인간에 이르기까지 잘 보존되어 있으며 흥미롭게도 히스톤 H2B에 일어나는 ubiquitylation에 의해 영향을 받습니다. 효모에서는 H2B ubiquitylation이 H3K4 methylation이 일어나는데 필수적이고 인간의 경우에도 H2B ubiquitylation이 H3K4 methylation에 영향을 미친다고 알려져 있습니다. 이러한 히스톤 modification 간의 상호작용을 히스톤 ‘cross-talk’이라고 지칭하며 DNA accessibility를 조절하는 방식에 더 깊은 다양성을 제공하고 있습니다.
2. 질문
배경지식에서 연급했던 H2B ubiquitylation 에 의존적인 H3K4 methylation은 가장 처음 밝혀진 히스톤 cross-talk이지만 아직 많은 부분이 의문으로 남아있습니다. 특히 ‘H2B ubiquitylation 이 어떤 기작을 통해 H3K4 methylation을 활성화시키는가?’는 이 cross-talk이 밝혀진 2000년 초부터 지금까지 가장 핵심적인 질문으로 자리하고 있습니다. 저는 단순하지만 하나의 H3K4 methyltransferase를 가지고 있고 H2B ubiquitylation 의존적 H3K4 methylation이 가장 잘 나타나는 장점을 가진 효모 시스템을 이용하여 이 질문의 답을 찾고자 하였습니다.
3. 발견
이 논문에서는 다양한 생화학적 기법을 통해서 효모의 H3K4 methylation을 담당하는 Set1 complex의 여러 부위가 어떤 기작을 통해 H2B ubiquitylation 의존적 H3K4 methylation을 수행하는지를 밝힙니다. 기본적으로는 8 개의 구성인자 (Set1, Bre2, Swd1, Spp1, Swd2, Swd3, Sdc1, Shg1)로 이루어진 Set1 complex를 순수정제하고 H2B ubiquitylation을 특이적으로 표지한 nucleosome을 재조합하여 마련하였고 이를 시험관 내 메틸화 반응에 이용하여 기존의 연구들이 쉽게 밝힐 수 없었던 Set1 complex의 각 부분들의 기능에 대해 다른 요소의 영향을 배제하고 세밀한 연구를 진행할 수 있었습니다. 기존에 H2B ubiquitylation 의존적 H3K4 methylation에 중요하다고 알려져 있던 Set1 complex의 구성인자인 Spp1의 각 domain에 대해 연구하여 PHDL이란 domain을 효모에서 제안하였고 이 domain이 Set1 complex의 여러 구성인자들 간의 결합을 매개하고 H2B ubiquitylation 의존적 H3K4 methylation에 중요함을 보였습니다. Spp1 이 없는 조건하에서 Set1의 특정 부분에 대한 결손을 유도하여 Set1의 n-terminal 부분이 H2B ubiquitylation 의존적 H3K4 methylation에 기능함을 보였습니다. 이를 통해 Spp1이 없을 때에도 Set1 complex가 가지는 H3K4 methylation 활성에 대해 설명할 수 있는 실험적 증거를 제시하고 기존에 밝혀져 있지 않았던 Set1 n-terminal 부분의 새로운 기능을 보였습니다. 또한 Spp1과 또 다른 구성인자인 Swd1의 인위적 fusion 후 정제한 Set1 complex의 경우 H2B ubiquitylation이 없는 조건에서도 H3K4 methylation이 일어날 수 있다는 점을 발견했는데 이는 이 논문의 가장 중요한 발견으로 Set1 complex의 H2B ubiquitylation 이 Set1 complex의 구성인자 간의 conformation에 영향을 주어 methylation을 활성화한다는 기작을 지지해 줍니다.
4. 후속
이번 연구를 수행하면서 가장 아쉬웠던 점은 Set1 complex와 H2B ubiquitylation을 지닌 nucleosome 사이의 결합을 규명하지 못한 점 입니다. Set1 complex 와 nucleosome의 결합 방식을 이해하고 생화학적 연구들을 연결할 수 있다면 H2B ubiquitylation 의존적 H3K4 methylation의 분자기작에 대한 더 깊은 지식을 얻을 수 있을 것 입니다.
5. 소감
이 논문이 나오기까지 여러 가설을 세우고 이를 증명하게 위한 실험을 수행하였습니다. 그 과정에서 가설이 맞는 경우도 있고 예상한 바와 다른 경우도 있었습니다. 가설이 틀리다는 것을 확인하는 과정 또한 중요하고 많은 배움이 있다는 점을 이번 연구를 통해 배울 수 있었습니다.
6. 기타
실험실 생활과 함께 시작하여 함께 끝마친 연구를 담고 있어 더 애착이 가는 논문입니다. 논문의 처음부터 마지막까지 함께 고민해주시고 도와주신 교수님과 김정애 박사님께 깊은 감사의 마음을 전합니다. 또 즐겁게 실험실 생활을 하는데 도움을 준 실험실 구성원분들께 감사합니다.




























