
< 사진 1. (왼쪽부터) KAIST 생명과학과 김찬혁 교수, 정원석 교수, 이세영 석박사통합과정, 정현철 박사 >
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
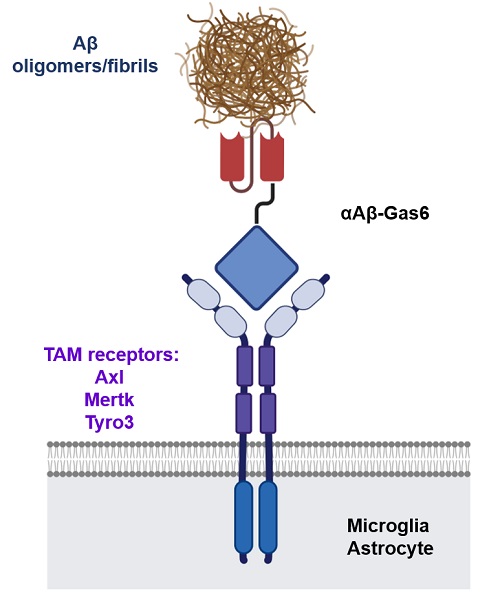
< 그림 1. Gas6 융합단백질의 모식도. 죽은 세포를 제거하는 기작을 응용해베타 아밀로이드를 TAM 포식 수용체를 통해 제거하게 유도함으로써 항체 치료의 문제점인 염증 반응을 획기적으로 해결함 >
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
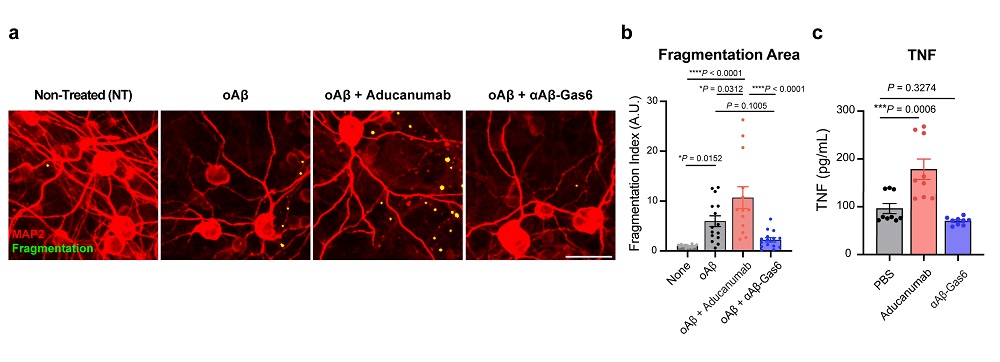
< 그림 2. Gas6 융합단백질에 의해 억제되는 신경 독성 및 염증 반응. a-c,베타 아밀로이드를 항체 치료제 (Aducanumab)를 통해 제거하게 유도할 경우 신경 독성 (a-b: 빨간 색 신경세포가 사멸하여 노란색 덩어리로 관찰됨)과 강한 염증 반응 (c: 염증성 싸이토카인 분비)을 유발함. 이와는 반대로 Gas6 융합 단백질 (αAβ-Gas6)을 통해 베타 아밀로이드를 제거할 경우 신경 독성과 염증 반응이 모두 사라짐을 관찰 >
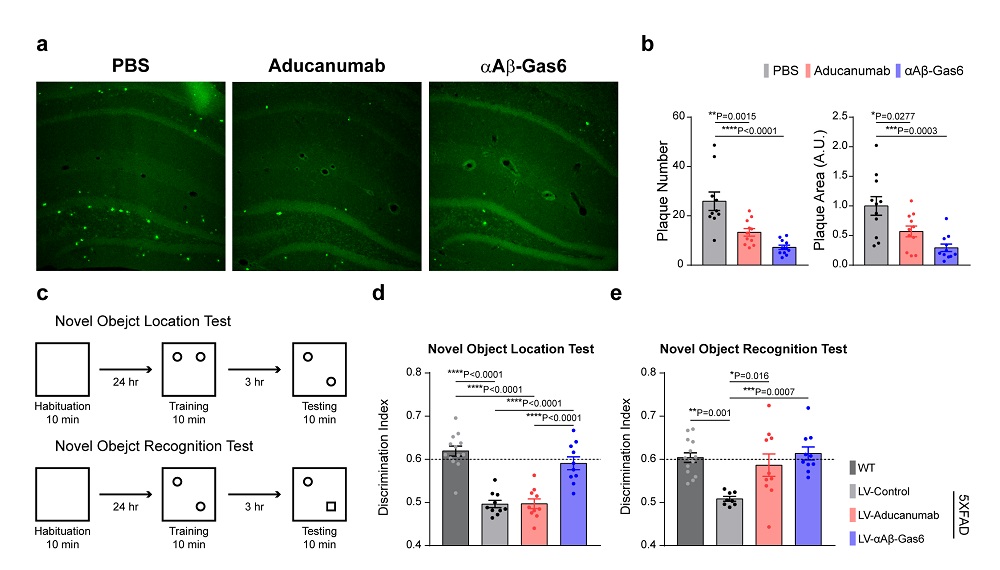
< 그림 3. Gas6 융합단백질에 의한 베타 아밀로이드 제거 및 인지 기능 개선. a-b, 알츠하이머 모델 쥐에서 관찰되는 베타 아밀로이드 (녹색)가 항체 치료제 (Aducanumab)보다도 더 효과적으로 Gas6 융합 단백질 (αAβ-Gas6)에 의해 사라짐을 확인. c-e, 알츠하이머 모델 쥐에서 두가지 행동 실험을 진행한 결과 Gas6 융합 단백질 (αAβ-Gas6)이 항체 치료제 (Aducanumanb)과 비교하여 현저히 증가된 인지 기능 개선 효과를 보임 >
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
https://news.kaist.ac.kr/news/html/news/?mode=V&mng_no=22890








