
< (왼쪽부터) KAIST 생명과학과 유다슬이 연구조교수, 허원도 교수, 김지혜 선임연구원, 유정혜 박사과정 >
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
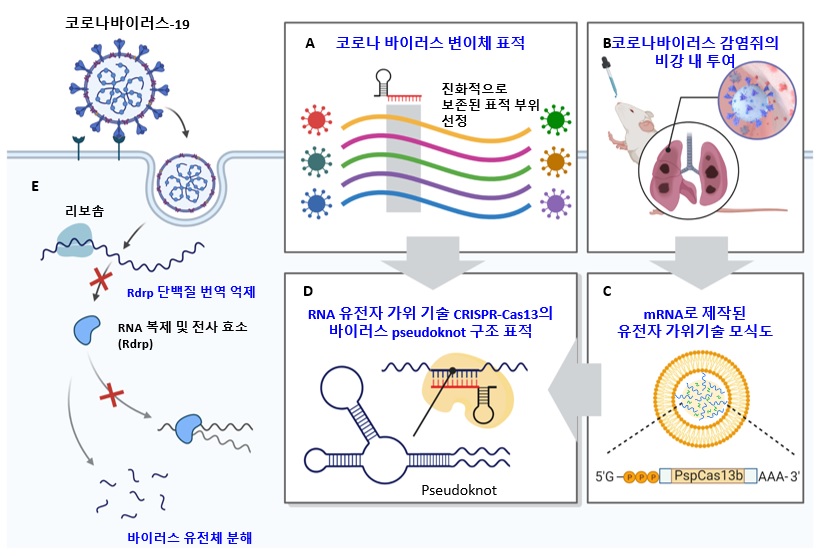
< A, 코로나 바이러스 변이체에 적용가능한 유전자 가위 기술 CRISPR-Cas13의 표적 부위 선별. 진화적으로 보존된 부위를 컴퓨터 계산 및 서열 비교를 통해 선정함. B, 코로나 바이러스 감염쥐에서의 효과 확인을 위한 mRNA로 제작된 CRISPR-Cas13 기술의 비강 내 투여. 비강 내 투여를 통해 mRNA가 쥐의 폐기관으로 효과적으로 전달되는 것을 확인함. C, mRNA로 제작된 유전자 가위 기술 CRISPR-Cas13의 비강 내 전달을 위한 모식도. mRNA의 안정성을 위해 지질막으로 싸여진 기술을 이용하여 mRNA를 전달함. D, 세포에서 단백질로 발현된 유전자 가위 기술 CRISPR-Cas13의 코로나 바이러스 RNA 표적 및 코로나 바이러스의 pseudoknot 구조. 코로나 바이러스 변이체에서 진화적으로 보존되었으며 바이러스 복제에 필수적인 부위인 psuedoknot을 표적함으로써 효과적으로 바이러스 유전체를 분해 및 억제할 수 있었음. E, 코로나 바이러스-19의 생활사 및 RNA 유전자 가위 CRISPR-Cas13 기반의 코로나 바이러스 유전체 표적 전략을 통한 바이러스 유전체 분해 모식도. RNA 바이러스 복제에 필수적인 Rdrp (RNA 복제 및 전사 효소)를 표적함으로써 코로나 바이러스의 복제 및 전사를 막고 효과적인 바이러스 유전체를 분해 할 수 있음. >
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
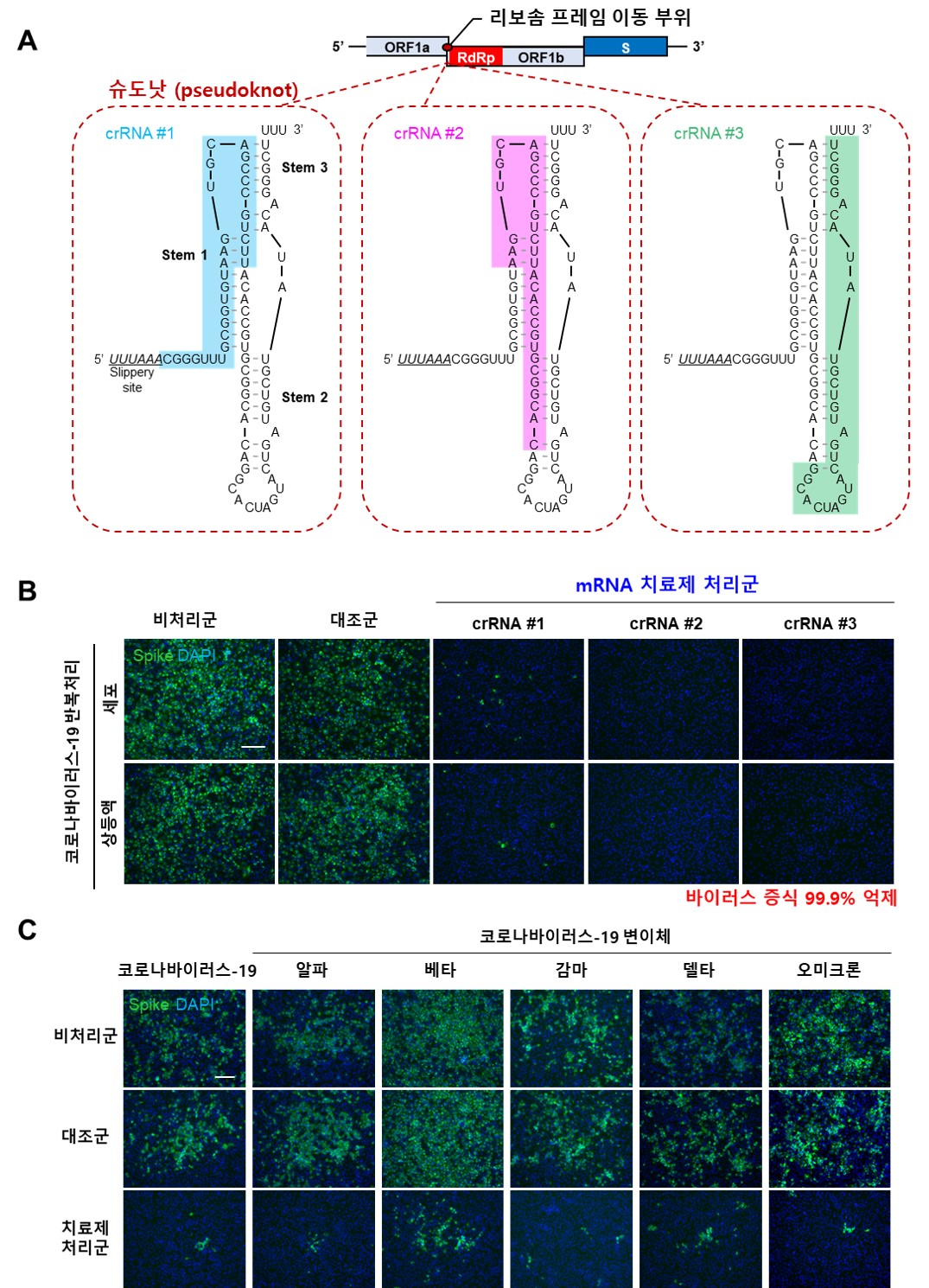
< 코로나바이러스-19 변이체에서 진화적으로 보존된 pseudoknot 구조를 타겟하는 범용 mRNA 치료제 처리에 따른 변이체 증식 억제 비교. Vero E6 세포의 범용 치료제 비처리군, 대조군, 치료제 처리군내에서 코로나바이러스-19 뿐만 아니라 변이체 모두 증식력이 효과적으로 억제됨을 확인함. >
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
< RNA 유전자 가위 기술을 이용한 범용 코로나 바이러스 감염병 mRNA 치료제 이미지 >
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.







 [김윤기 교수님] 새로운 단백질 번역기전 규명
[김윤기 교수님] 새로운 단백질 번역기전 규명
 [전상용 교수님] 항암치료용 인공탄수화물 기반 나노의약 개발
[전상용 교수님] 항암치료용 인공탄수화물 기반 나노의약 개발

