 |
|
▲ (왼쪽부터) KAIST 생명과학과 이은별 박사, 정연주 박사, 정원석 교수 (사진=카이스트) |
카이스트(총장 이광형)는 생명과학과 정원석 교수와 이은별 박사, 정연주 박사 연구팀이 노화된 뇌에서 기존에 알려지지 않은 새로운 종류의 별아교세포를 발견했고, 이들이 세포 내 단백질 항상성이 손상돼 시냅스 생성 및 제거와 같은 기본적 능력이 결여돼있음을 밝혀 노화 관련 네이처 자매지인 ‘네이처 에이징(Nature Aging)’에 공개했다고 8일 밝혔다.
정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포가 신경세포의 시냅스를 만들 수도 또는 제거할 수도 있음을 밝힌 바 있다. 하지만, 이 같은 별아교세포의 기능이 노화 과정에서 어떻게 변화하는지는 알려지지 않았다. 연구팀은 노화된 뇌에서 별아교세포의 기능 변화를 이해하고자 단일 세포RNA 시퀀싱을 수행했고, 그 결과 기존에 노화 및 질병 뇌에서 존재한다고 알려진 염증성 별아교세포가 아닌 새로운 종류의 별아교세포가 존재함을 발견했다.
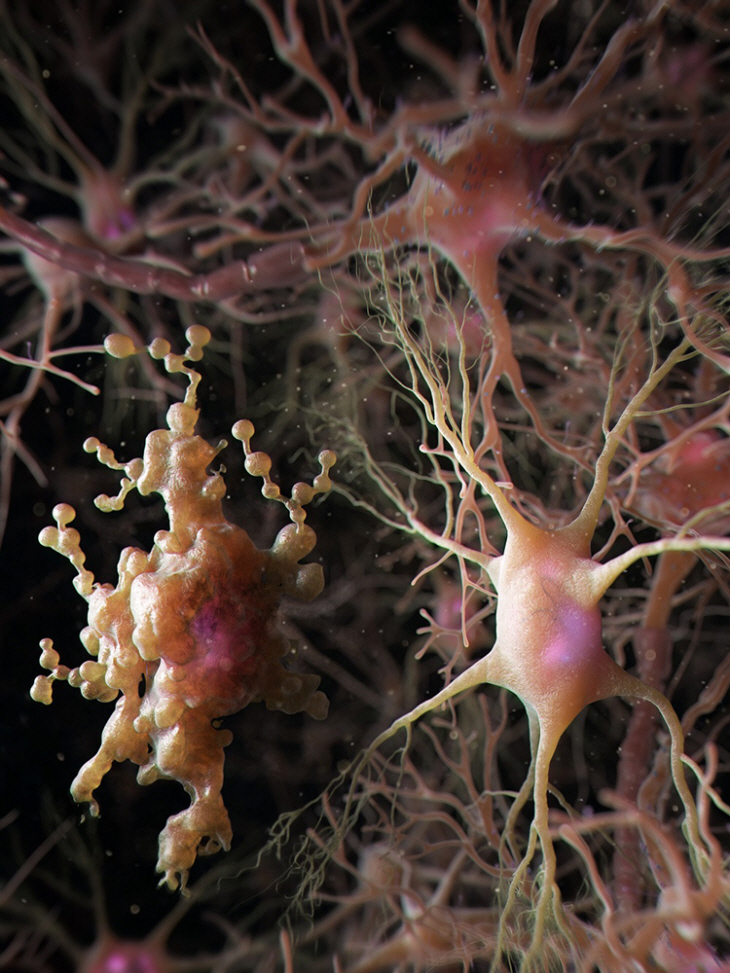
흥미롭게도 이들은 뇌에서 단기 기억을 저장한다고 알려진 해마에서만 노화 과정에서 선택적으로 생겨났으며, 이들 세포 내에는 불필요한 단백질을 제거하는 기전으로 알려진 자가포식(autophagy) 과정에서 생겨나는 오토파고좀(autophagosome)이 무분별하게 축적돼 있음을 밝혔다. 오토파고좀은 자가포식 과정에서 생겨나는 주머니 형태의 세포 소기관으로 세포내 불필요한 물질을 제거하기 위한 자가포식소체를 일컫는다. 이 같은 특징을 나타내기 위해서 연구진들은 중의적인 표현으로 새로 발견한 별아교세포를 ‘아프다(APDA: AutoPhagy-Dysregulated Astrocyte)’ 세포로 명명했다.
별아교세포는 미세한 잔가지들을 통해서 수만 개의 시냅스를 감싸고 있으며, 글루타메이트(glutamate) 및 가바(GABA)와 같은 신경 전달 물질 및 다양한 이온들의 농도를 조절하는 역할을 수행함이 알려져 있다. 놀랍게도 APDA 세포들에서는 다양한 단백질들이 본래 위치에서 벗어나 오토파고좀에 갇혀 있는 현상이 발견됐으며 이로 인해 별아교세포가 시냅스를 만들거나 제거하는 능력이 모두 상실돼있음을 발견했다.
연구진은 자가포식 작용이 비정상적으로 조절되고 있음에 착안해 자가포식 작용에 영향을 주는 다양한 기전을 연구한 결과, 노화가 진행될수록 해마에 존재하는 별아교세포에서만 엠토르 (mTOR: 세포의 성장과 분열을 조절하는 단백질 합성의 신호체계)와 프로테아좀 (proteasome: 단백질 분해 효소 복합체) 활성도가 크게 감소함을 확인하였다. 이 두 기전은 원래 자가포식 작용을 제어하는 기전으로 알려져 있었는데 노화가 진행됨에 따라 다른 세포보다도 별아교세포에서 엠토르와 프로테아좀 기능이 감소함에 따라 자가포식 작용이 무분별하게 발생함을 밝힌 것이다. 그뿐만 아니라 이렇게 만들어진 오토파고좀들이 원래는 리소좀(lysosome)에 의해 분해돼 제거되나, APDA 세포들은 리소좀의 활성마저도 감소해 있음을 보였다.
이로써 세포 내 단백질 항상성을 조절하는 중요한 세 가지 기전 (엠토르, 프로테아좀, 리소좀)들이 모두 해마에 존재하는 별아교세포에서 노화에 따라 선택적으로 감소함에 따라, APDA 세포가 생겨남을 연구진은 보였다. 연구진은 실제 노화가 일어나지 않은 9개월령 쥐에게서도 엠토르 및 프로테아좀을 약물로써 감소시켰을 때 인위적으로 노화된 뇌에서 발견되는 APDA 세포를 만들 수 있음을 확인했다.
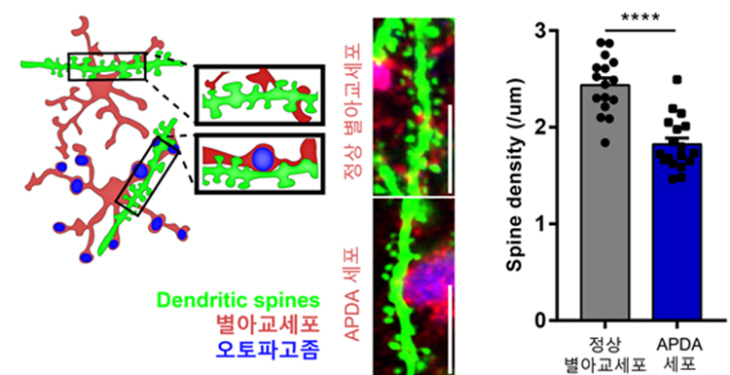
연구진은 이러한 비정상적인 APDA 세포의 주변에 있는 시냅스들이 제대로 배열돼 있지 못하고 또한 그 숫자가 감소해 있음을 발견해 노화된 뇌에서 발생하는 시냅스 손상 및 뇌인지 기능 저하가 비정상적인 기능을 가진 APDA 세포에서 기인 할 수 있음을 제시했다. 또한 연구진은 치매 모델 쥐에서는 이 같은 APDA 세포가 정상 쥐의 노화 과정에서 보다 훨씬 더 빨리 해마에서 생겨남을 발견해 이들이 치매에서 나타나는 인지 기능 저하에도 역할을 할 수 있음을 보였다.
현재 노화된 뇌나 퇴행성 뇌 질환에서 교세포의 연구는 주로 염증성 교세포와 이들의 역할에 집중돼왔다. 연구팀의 이번 발견은 노화 및 치매 뇌에서 염증성 별아교세포와는 전혀 다른 종류의 비정상적 별아교세포가 존재함을 밝힌 첫 번째 연구 결과이며, 이들이 시냅스의 항상성을 무너뜨릴 수 있음을 제시했다.
연구팀은 이번 연구가 현재 노화를 극복하기 위해 엠토르를 전체적으로 억제하려는 현재 패러다임이 오히려 비정상적인 APDA 세포의 생성을 촉진할 수도 있음을 시사한다고 언급하며, 향후 연구에서는 노화 극복 방안이 세포 특이적으로 세분화돼야 함을 강조했다.
카이스트 생명과학과 이은별 박사과정 학생과 정연주 박사 후 연구원이 공동 제1저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 ‘네이쳐 에이징 (Nature Aging)’에 지난 8월 1일 자로 온라인 공개됐으며 (논문명: A distinct astrocyte subtype in the aging mouse brain characterized by impaired protein homeostasis), 같은 저널에 News & Views (Astrocytic traffiic jams in the aging brain)에도 소개되었다.
한편, 이번 연구는 삼성미래기술육성재단과 치매극복연구개발사업단의 도움을 받아 진행됐다.
연구진은 이러한 비정상적인 APDA 세포의 주변에 있는 시냅스들이 제대로 배열돼 있지 못하고 또한 그 숫자가 감소해 있음을 발견해 노화된 뇌에서 발생하는 시냅스 손상 및 뇌인지 기능 저하가 비정상적인 기능을 가진 APDA 세포에서 기인 할 수 있음을 제시했다. 또한 연구진은 치매 모델 쥐에서는 이 같은 APDA 세포가 정상 쥐의 노화 과정에서 보다 훨씬 더 빨리 해마에서 생겨남을 발견해 이들이 치매에서 나타나는 인지 기능 저하에도 역할을 할 수 있음을 보였다.
현재 노화된 뇌나 퇴행성 뇌 질환에서 교세포의 연구는 주로 염증성 교세포와 이들의 역할에 집중돼왔다. 연구팀의 이번 발견은 노화 및 치매 뇌에서 염증성 별아교세포와는 전혀 다른 종류의 비정상적 별아교세포가 존재함을 밝힌 첫 번째 연구 결과이며, 이들이 시냅스의 항상성을 무너뜨릴 수 있음을 제시했다.
연구팀은 이번 연구가 현재 노화를 극복하기 위해 엠토르를 전체적으로 억제하려는 현재 패러다임이 오히려 비정상적인 APDA 세포의 생성을 촉진할 수도 있음을 시사한다고 언급하며, 향후 연구에서는 노화 극복 방안이 세포 특이적으로 세분화돼야 함을 강조했다.
카이스트 생명과학과 이은별 박사과정 학생과 정연주 박사 후 연구원이 공동 제1저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 ‘네이쳐 에이징 (Nature Aging)’에 지난 8월 1일 자로 온라인 공개됐으며 (논문명: A distinct astrocyte subtype in the aging mouse brain characterized by impaired protein homeostasis), 같은 저널에 News & Views (Astrocytic traffiic jams in the aging brain)에도 소개되었다.
한편, 이번 연구는 삼성미래기술육성재단과 치매극복연구개발사업단의 도움을 받아 진행됐다.
 |
|
▲ APDA세포를 3D 형상화 한 이미지. 오른쪽의 정상 별아교세포에 비해 왼쪽의 APDA세포들은 오토파고좀이 세포체 및 잔가지에 축적되어 있음. 노화 과정에서 해마 별아교세포 특이적으로 일어나는 단백질 항상성 조절 기전 감소에 의해 APDA 세포들이 발생함을 밝힘 |
 |
|
▲ APDA세포와 근접하게 위치하고 있는 신경세포들의 잔가지들을 관찰한 결과 시냅스의 구조 및 수가 비정상적으로 감소해 있음을 발견. 노화에 따른 인지 기능 저하를 일으키는 새로운 원인으로 작용할 것이라 예상 (자료=카이스트)
< 저작권자 ⓒ 에너지경제 무단전재 및 재배포 금지 / 대한민국 경제의 힘, 에너지경제> |








