 |
|
▲ KAIST 생명과학과 김학성 교수(왼쪽)와 제1저자 배진호 박사 (사진=카이스트) |
이번 연구 성과는 국제 저명 학술지인 ‘어드밴스드 사이언스(Advanced Science)’ (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
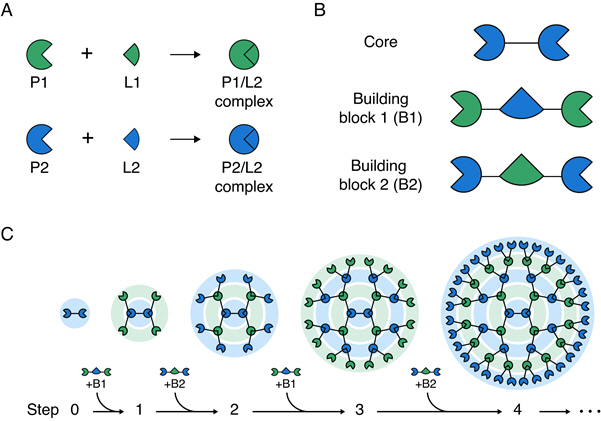
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
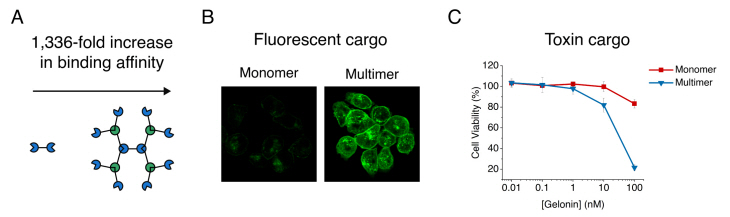
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것"이라고 말했다.
이 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것"이라고 말했다.
이 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
 |
|
▲ 거대 단백질을 조립하기 위한 순차적, 교대 결합 방식의 모식도 |
 |
|
▲ 구조체의 효율적인 세포 내 단백질 전달 효과 (자료=카이스트)
|







 [정현정 교수님] 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
[정현정 교수님] 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
 한진희 교수님_기억이 만들어지는 원리 최초로 규명했다
한진희 교수님_기억이 만들어지는 원리 최초로 규명했다

