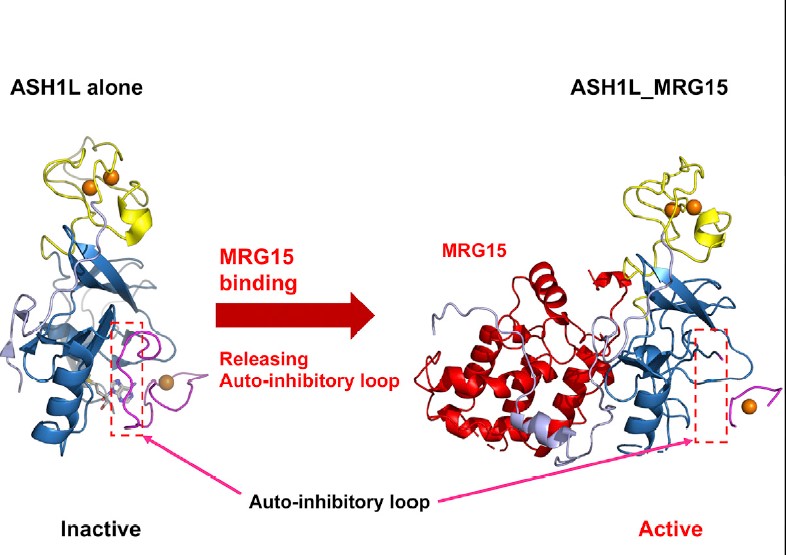
<그림. MRG15 binding to ASH1L releases the autoinhibitory loop, and activates ASH1L histone methyltransferase activity>
1. 배경지식
DNA는 히스톤 H2A, H2B, H3, H4가 각각 한 쌍씩 8개로 결합해 이루어진 octamer에 감겨, 크로마틴의 가장 기본 단위인
nucleosome을 이룹니다. 히스톤 단백질의 N-말단 꼬리에는 methylation, acetylation, ubiquitination 등 다양한 종류의 변형이
일어나게 되고, 그에 따라 유전자 발현이 조절 되게 됩니다. ASH1L은 Ash1의 포유류 동족체 (mammalian homolog)로서,
히스톤 H3 K36의 메틸 전이 효소 (Methyltransferase) 입니다. ASH1L에 의해 생성된 H3K36me2는 포유류와 초파리에서 유전자 전사를 촉진시킨다고 알려진 바가 있습니다. 2011년도에 ASH1L catalytic domain의 구조 규명을 통해, ASH1L의 기질 결합 포켓 (substrate binding pocket)이 자동 억제 루프(Auto-inhibitory loop)에 의해 가려짐에 따라, 제한적인 메틸 전이 효소 활성(Methyltransferase activity)을 보인다는 것이 밝혀졌습니다 (An et al., 2011). 그리고, 그 후 발표된 연구결과에서 ASH1L이 MRG15과 Caf1(p55)와 복합체를 이룬다는 것이 알려졌고, 그 중 MRG15이 ASH1L에 결합함에 따라 ASH1L의 메틸 전이 효소 활성이 증가하는 것이 밝혀졌습니다 (Schmähling et al., 2018, Huang et al., 2017). 이에 따라, MRG15의 결합에 의해 ASH1L의 활성이 촉진되는 자세한 기작을 알아보기 위해, 구조생화학적 접근으로 ASH1L-MRG15복합체에 대해 연구하게 되었습니다.
2. 질문
MRG15의 결합이 어떻게 후성 유전 단백질 ASH1L의 활성을 촉진 시키는가?
3. 발견
ASH1L-MRG15 복합체를 발현, 정제, 결정화 시켜 구조를 규명함에 따라서 ASH1L과 MRG15이 서로 상호작용 하는 그림을 더 잘 이해할 수 있게 되었습니다. 우선, 규명된 구조가ASH1L과 MRG15의 결합이 conserved된 FxLP motif를 통해 이루어진다고 발표된 이전의 연구결과(Schmähling et al., 2018) 에 상응하는 것을 확인했습니다. ASH1L의 경우, motif가 아미노산 F-Q-L-P로 이루어져 있는데, 이 부분과 MRG15의 C-말단에 존재하는 MRG domain가 긴밀하게 상호작용하는 것을 관찰할 수 있었습니다. FQLP의 중요성을 좀 더 시험해 보기 위해, F (Phenylalanine)과 L (Leucine) 돌연변이 단백질로 각각 정제된 ASH1L 단백질과 wildtype MRG15 단백질의 Pull-down 실험을 진행한 결과, 돌연변이가 상호작용을 감소시키는 것으로 확증되었습니다. 뿐만 아니라, 그 외에 ASH1L과 MRG15이 상호작용 하는 데에 주요역할을 할 것으로 보이는 아미노산을 (R265, R269 of MRG15) 추려서 똑같은 방법으로 실험을 진행하였고, 이들 역시 상호작용을 저해하는 것으로 확인되었습니다. 또한, 흥미로운 것은 얻게 된 두 종류의 구조에서 모두 ASH1L의 auto-inhibitory loop이 존재하던 post-SET 도메인 부분이 상당히 disorder 되어있었다는 점입니다. 비록, 아쉽게도 resolution의 제한으로 이 부분의 명확한 구조는 얻지 못했지만, MRG15의 결합에 의해 auto-inhibitory loop에 변화가 일어나며, 이로써 ASH1L의 활성이 조절된다는 것으로 결론지을 수 있었습니다.
4. 후속
앞서 언급했듯이, ASH1L과 복합체를 이룬다고 알려진 단백질은 MRG15외에도 Caf1(p55)이 있고, 복합체 내에서 p55의 역할은 정확히 알려진 바가 아직 없기에, 이에 대한 후속 연구가 진행 중에 있습니다. 또한, 이번 논문에는 싣지 못했지만, 여러 실험을 통해서 nucleosome에 달린 extra DNA의 길이에 따라 ASH1L-MRG15의 활성이 변하는 것을 관찰하였고, nucleosomal environment 차원의 ASH1L-MRG15활성을 위한 요건이 존재할 것으로 생각됩니다. 그리고, histone methyltransferase assay 실험을 통해서, ASH1L이 Chromodomain을 포함한 full-length MRG15(a.a. 1-323)과 복합체를 이루었을때, MRG domain(a.a.151-323)만 포함한 MRG15보다 더 많은 활성을 보이는 것으로 관찰되었습니다. 이에 따라, ASH1L-MRG15복합체의 활성에 대한 MRG15 Chromodomain의 역할이 무엇인지도 알아볼 수 있을 것으로 기대됩니다.
5. 소감
2018년 참석했던 한 학회에서 동일한 구조로 연구를 진행하고 있는 그룹에 대한 소식을 듣고, 그 그룹과 논의 후, 예정보다 급하게 논문을 마무리 짓게 되었습니다. 그간 프로젝트에 대해 그리고 있던 큰 그림이 바뀌고, 계획되어 있던 실험들이 갑자기 들이닥친 deadline에 맞춰 없어지거나 뒤로 미뤄져야 하는 상황에 그 시점에 가지고 있던 데이터로 어떻게 의미 있는 스토리를 만들 수 있을까 고민하는 과정이 쉽지 않았습니다. 연구가 진행됨에 따라서, 기존에 있던 가설들이 바뀔 수 있고 이에 침착하게 대응하며 열린 마음으로 연구에 임해야 함을 배우게 되었습니다.
6. 기타
물심양면으로 연구지도를 해주신 송지준 교수님, 그리고 많은 면에서 도움을 아끼지 않은 실험실 동료들에게 감사의 말씀을 드립니다.







 박진아 (대사신호전달 연구실, 김세윤 교수님)
박진아 (대사신호전달 연구실, 김세윤 교수님)
 김지훈 (바이오이미징 & 광유전학 연구실, 허원도 교수님)
김지훈 (바이오이미징 & 광유전학 연구실, 허원도 교수님)



















